Prümm Feuchtemesstechnik & Prümm Unternehmensberatung
Ihre Partner in Europa für Feuchtemessungen in gasförmigen Stoffen.
Your partners in Europe for humidity-measurement of gas.
Elktrolytische-Verfahren
Unter Elektrolyse fasst man alle Vorgänge zusammen, bei denen der elektrische Gleichstrom chemische Reaktionen einleitet und unterhält. Das besondere Merkmal dieser Reaktionen sind Veränderungen, die mit einem Ladungsaustausch verbunden sind. Für ihren Ablauf müssen daher Ladungen transportiert werden, d.h., durch den Elektrolyten, in dem die chemischen Veränderungen stattfinden, muß ein Strom fließen. Aus diesem Grund sind Elektrolysen auf Lösungen und Salzschmelzen beschränkt, weil hier Ionen vorliegen, die den Stromtransport übernehmen. Mit dem Fließen einer bestimmten Elektrizitätsmenge ist die Veränderung einer bestimmten Stoffmenge verbunden. Dieser Zusammenhang wurde von M. Faraday im 1. Faradayschen Gesetz beschrieben: Die bei der Elektrolyse abgeschiedenen Stoffmengen sind der Stromstärke und der Zeit proportional.
m = Ä∙I∙t m : Masse des zersetzten Wassers [mg]
Ä : elektrochemisches Äquivalent [mg/As]
I : Stromstärke [ A ]
t : Zeit [ s ]
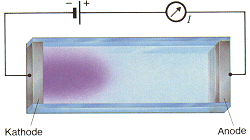
Der apparative Aufbau ist prinzipiell für alle Elektrolysen gleich. Der sogenannte Elektrolysentrog enthält den Elektrolyten, der eine Lösung oder eine Salzschmelze sein kann. In diesen ragen die Elektroden hinein, die mit einer Gleichspannungsquelle verbunden sind.
Der Aufbau des Phosphorpentoxidsensors
Der Phosphorpentoxidsensor besteht aus einem Glaskörper auf dem zwei voneinander getrennte Platindrahtwicklungen aufgebracht sind. Dies sind die Elektroden. Als Elektrolyt wird eine wässerige Lösung von Phosphorpentoxid, die sogenannte Phosphorsäure, auf den Glaskörper mit den Platindrahtwindungen aufgebracht. Die beiden Enden der Platindrahtwindungen werden an eine Gleichstromquelle angeschlossen. Es fließt ein Strom durch den Elektrolyten wobei das Wasser in seine Bestandteile Wasserstoff und Sauerstoff entsprechend der folgenden Reaktionen zersetzt wird.
Die Wasseraufnahme des Diphosphorpentoxids wird durch folgende Reaktion beschrieben:
P4O10 + 2H2O →(HPO3) 4
Die wässerigen Phosphorsäure ( HPO3)4 dissoziiert in 4 H+ Anionen und 4(PO3)- Kationen.
(HPO3)4 → 4H+ + 4(PO3)-
Bei Anlegen einer Gleichspannung, meist unter 2 V, wandern die 4H+-Ionen zur Kathode und die 4(PO3)- - Ionen zur Anode. An den Elektroden laufen folgende Reaktionen ab:
Kathode (negativer Pol): 4H+ + 4e- → 2H2 ↑
Anode (positiver Pol): 4(PO3)- → P4O10 + 4e- + O2 ↑
Die Summe der Gesamtreaktion an Anode und Kathode und der Bildungsgleichung der Phosphorsäure ergibt:
4HPO3 ↔ P4O10 + 2H2 ↑ + O2 ↑
Diese Gleichung zeigt, dass sich unter der Einwirkung des elektrischen Stromes das Wasser in seine Bestandteile Wasserstoff H2 und Sauerstoff O zerlegt hat. Die Phosphorsäure dagegen hat sich nicht verändert. Sie hat nur Ladungsträger (Ionen) geliefert. Wenn aber das Wasser zerlegt wird, konzentriert sich die Säure so lange auf, bis wieder P4O10 als weißes Pulver vorliegt und der Elektrolysestrom gegen Null geht.
(HPO3)4 - 2H2O → P4O10
Wird aber das zerlegte Wasser durch Wasser aus einem feuchten Gasstrom ersetzt und somit die Konzentration der Säure konstant gehalten, so ist auch der Elektrolysestrom konstant und nach dem Faradayschen Gesetz proportional der Menge des zersetzten Wassers. Bei konstantem Volumenstrom des feuchten Gases ist der Elektrolysestrom im Konzentrationsgleichgewicht ein direktes Maß für die Feuchte des Gases.
Der Phosphorpentoxidsensor gehört zur Gruppe der direkt und absolut messenden Feuchtemessgeräten. Er arbeitet ohne Drift und Hysterese und bedarf keiner Kalibrierung. Der Messbereich dieser Geräte liegt zwischen 3ppmv bis 2500ppmv. Das entspricht einem Taupunktbereich von -90°C bis -15°C. Phosphorpentoxidsensoren können aufgrund der verwendeten Materialien auch in stark korrosiven Gasströmungen, wie CL2, HCl, H2S, H2SO4, HBr, SO2, O3, PH3 oder SF6, verwendet werden. Ebenso ist er bei Verunreinigungen mit Kohlenwasserstoffen einsetzbar.